Entacapone
Entacapone Prescribing Information
Entacapone tablets are indicated as an adjunct to levodopa and carbidopa to treat end-of-dose “wearing-off” in patients with Parkinson’s disease (see
Entacapone is a selective and reversible inhibitor of COMT.
In mammals, COMT is distributed throughout various organs with the highest activities in the liver and kidney. COMT also occurs in the heart, lung, smooth and skeletal muscles, intestinal tract, reproductive organs, various glands, adipose tissue, skin, blood cells, and neuronal tissues, especially in glial cells. COMT catalyzes the transfer of the methyl group of S-adenosyl-L-methionine to the phenolic group of substrates that contain a catechol structure. Physiological substrates of COMT include dopa, catecholamines (dopamine, norepinephrine, and epinephrine) and their hydroxylated metabolites. The function of COMT is the elimination of biologically active catechols and some other hydroxylated metabolites. In the presence of a decarboxylase inhibitor, COMT becomes the major metabolizing enzyme for levodopa, catalyzing the metabolism to 3-methoxy-4-hydroxy-L-phenylalanine (3-OMD) in the brain and periphery.
The mechanism of action of entacapone is believed to be through its ability to inhibit COMT and alter the plasma pharmacokinetics of levodopa. When entacapone is given in conjunction with levodopa and an aromatic amino acid decarboxylase inhibitor, such as carbidopa, plasma levels of levodopa are greater and more sustained than after administration of levodopa and an aromatic amino acid decarboxylase inhibitor alone. It is believed that at a given frequency of levodopa administration, these more sustained plasma levels of levodopa result in more constant dopaminergic stimulation in the brain, leading to greater effects on the signs and symptoms of Parkinson’s disease. The higher levodopa levels also lead to increased levodopa adverse effects, sometimes requiring a decrease in the dose of levodopa.
In animals, while entacapone enters the central nervous system (CNS) to a minimal extent, it has been shown to inhibit central COMT activity. In humans, entacapone inhibits the COMT enzyme in peripheral tissues. The effects of entacapone on central COMT activity in humans have not been studied.
When 200 mg entacapone is administered together with levodopa and carbidopa, it increases the area under the curve (AUC) of levodopa by approximately 35% and the elimination half-life of levodopa is prolonged from 1.3 hours to 2.4 hours. In general, the average peak levodopa plasma concentration and the time of its occurrence (Tmaxof 1 hour) are unaffected. The onset of effect occurs after the first administration and is maintained during long-term treatment. Studies in Parkinson’s disease patients suggest that the maximal effect occurs with 200 mg entacapone. Plasma levels of 3-OMD are markedly and dose-dependently decreased by entacapone when given with levodopa and carbidopa.
Entacapone pharmacokinetics are linear over the dose range of 5 mg to 800 mg, and are independent of levodopa and carbidopa coadministration. The elimination of entacapone is biphasic, with an elimination half-life of 0.4 hour to 0.7 hour based on the β-phase and 2.4 hours based on the γ-phase. The γ-phase accounts for approximately 10% of the total AUC. The total body clearance after intravenous administration is 850 mL per min. After a single 200 mg dose of entacapone tablets , the Cmaxis approximately 1.2 mcg per mL.
The effectiveness of entacapone tablets as an adjunct to levodopa in the treatment of Parkinson’s disease was established in three 24-week multicenter, randomized, double-blind, placebo-controlled studies in patients with Parkinson’s disease. In two of these studies, patients had motor “fluctuations”, characterized by documented periods of “On” (periods of relatively good functioning) and “Off” (periods of relatively poor functioning), despite optimum levodopa therapy. There was also a withdrawal period following 6 months of treatment. In the third study, patients were not required to have motor fluctuations. Prior to the controlled part of the studies, patients were stabilized on levodopa for 2 weeks to 4 weeks. Entacapone tablets have not been systematically evaluated in patients who have Parkinson’s disease without motor fluctuations.
In the first two studies to be described, patients were randomized to receive placebo or entacapone 200 mg administered concomitantly with each dose of levodopa and carbidopa (up to 10 times daily, but averaging 4 doses to 6 doses per day). The formal double-blind portion of both studies was 6 months long. Patients recorded the time spent in the “On” and “Off” states in home diaries periodically throughout the duration of the study. In one study, conducted in the Nordic countries, the primary outcome measure was the total mean time spent in the “On” state during an 18-hour diary recorded day (6 AM to midnight). In the other study, the primary outcome measure was the proportion of awake time spent over 24 hours in the “On” state.
In addition to the primary outcome measure: the amount of time spent in the “Off” state, subparts of the Unified Parkinson’s Disease Rating Scale (UPDRS) including mentation (Part I), activities of daily living (ADL) (Part II), motor function (Part III), complications of therapy (Part IV), and disease staging (Part V and VI) were assessed. Additional secondary endpoints included the investigator’s and patient’s global assessment of clinical condition, a 7-point subjective scale designed to assess global functioning in Parkinson’s disease; and the change in daily levodopa and carbidopa dose.
In one of the studies, 171 patients were randomized in 16 centers in Finland, Norway, Sweden, and Denmark (Nordic study), all of whom received concomitant levodopa plus dopa-decarboxylase inhibitor (either levodopa and carbidopa or levodopa and benserazide). In the second study, 205 patients were randomized in 17 centers in North America (US and Canada); all patients received concomitant levodopa and carbidopa.
The following tables display the results of these two studies:
| *Mean; the month 6 values represent the average of weeks 8, 16, and 24, by protocol-defined outcome measure, except for Investigator’s and Patient’s Global Improvement.**At least one category change at endpoint. ***Not an endpoint for this study but primary endpoint in the North American Study. ‡ Not significant. ‡‡ P values for Secondary Measures and Other Secondary Measures are nominal P values without any adjustment for multiplicity. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measure from Home Diary (from an 18-hour Diary Day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 9.2 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 9.3 | +1.5 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Duration of “On” time after first AM dose (hrs) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 2.2 | 0.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 2.1 | +0.2 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures from Home Diary (from an 18-hour Diary Day) ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 5.3 | 0.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 5.5 | - 1.3 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Proportion of Awake Time “On”***(%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 63.8 | +0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 62.7 | +9.3 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 705 | +14 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 701 | -87 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intakes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.1 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.2 | -0.4 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Other Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Investigator’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 28 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 56 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Patient’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 22 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 39 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 37.4 | -1.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 38.5 | -4.8 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 24.6 | -0.7 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 25.5 | -3.3 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 11.0 | -0.4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 11.2 | -1.8 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| *Mean; the month 6 values represent the average of weeks 8, 16, and 24, by protocol-defined outcome measure, except for Investigator’s and Patient’s Global Improvement.**At least one category change at endpoint. ***Score change at endpoint similarly to the Nordic Study. ‡ Not significant. ‡‡ P values for Secondary Measures and Other Secondary Measures are nominal P values without any adjustment for multiplicity. Effects on “On” time did not differ by age, sex, weight, disease severity at baseline, levodopa dose and concurrent treatment with dopamine agonists or selegiline | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measure from Home Diary (for a 24-hour Diary Day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Percent of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 60.8 | +2.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 60.0 | +6.7 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures from Home Diary (from an 24-hour Diary Day) ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.6 | -0.3 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.8 | -1.2 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 10.3 | +0.4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 10.2 | +1.0 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 758 | +19 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 804 | -93 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intakes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.0 | +0.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.2 | 0.0 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Other Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Investigator’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 21 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 34 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Patient’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 20 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 31 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 35.6 | +2.8 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 35.1 | -0.6 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 22.6 | +1.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 22.0 | -0.9 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 11.7 | +1.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 11.9 | 0.0 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Withdrawal of entacapone
In the third placebo-controlled study, a total of 301 patients were randomized in 32 centers in Germany and Austria. In this study, as in the other two studies, entacapone 200 mg was administered with each dose of levodopa and dopa decarboxylase inhibitor (up to 10 times daily) and UPDRS Parts II and III and total daily “On” time were the primary measures of effectiveness. The following results were observed for the primary measures, as well as for some secondary measures:
| * Total population; score change at endpoint. ** Fluctuating population, with 5 doses to 10 doses; score change at endpoint. *** Total population; at least one category change at endpoint. ‡ Not significant. ‡‡ P values for Secondary Measures are nominal P values without any adjustment for multiplicity. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6 | p-value vs. placebo (LOCF) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 12.0 | +0.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 12.4 | -0.4 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 24.1 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 24.9 | -2.5 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 10.1 | +0.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 10.2 | +1.1 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6 | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 37.7 | +0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 39.0 | -3.4 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Percent of Awake Time “On” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 59.8 | +3.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 62.0 | +6.5 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.8 | -0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.3 | -1.2 | 0.07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg)* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 572 | +4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 566 | -35 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intake* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 5.6 | +0.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 5.4 | 0.0 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Global (overall) % Improved*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 34 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 38 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
The effectiveness of entacapone tablets as an adjunct to levodopa in the treatment of Parkinson’s disease was established in three 24-week multicenter, randomized, double-blind, placebo-controlled studies in patients with Parkinson’s disease. In two of these studies, patients had motor “fluctuations”, characterized by documented periods of “On” (periods of relatively good functioning) and “Off” (periods of relatively poor functioning), despite optimum levodopa therapy. There was also a withdrawal period following 6 months of treatment. In the third study, patients were not required to have motor fluctuations. Prior to the controlled part of the studies, patients were stabilized on levodopa for 2 weeks to 4 weeks. Entacapone tablets have not been systematically evaluated in patients who have Parkinson’s disease without motor fluctuations.
In the first two studies to be described, patients were randomized to receive placebo or entacapone 200 mg administered concomitantly with each dose of levodopa and carbidopa (up to 10 times daily, but averaging 4 doses to 6 doses per day). The formal double-blind portion of both studies was 6 months long. Patients recorded the time spent in the “On” and “Off” states in home diaries periodically throughout the duration of the study. In one study, conducted in the Nordic countries, the primary outcome measure was the total mean time spent in the “On” state during an 18-hour diary recorded day (6 AM to midnight). In the other study, the primary outcome measure was the proportion of awake time spent over 24 hours in the “On” state.
In addition to the primary outcome measure: the amount of time spent in the “Off” state, subparts of the Unified Parkinson’s Disease Rating Scale (UPDRS) including mentation (Part I), activities of daily living (ADL) (Part II), motor function (Part III), complications of therapy (Part IV), and disease staging (Part V and VI) were assessed. Additional secondary endpoints included the investigator’s and patient’s global assessment of clinical condition, a 7-point subjective scale designed to assess global functioning in Parkinson’s disease; and the change in daily levodopa and carbidopa dose.
In one of the studies, 171 patients were randomized in 16 centers in Finland, Norway, Sweden, and Denmark (Nordic study), all of whom received concomitant levodopa plus dopa-decarboxylase inhibitor (either levodopa and carbidopa or levodopa and benserazide). In the second study, 205 patients were randomized in 17 centers in North America (US and Canada); all patients received concomitant levodopa and carbidopa.
The following tables display the results of these two studies:
| *Mean; the month 6 values represent the average of weeks 8, 16, and 24, by protocol-defined outcome measure, except for Investigator’s and Patient’s Global Improvement.**At least one category change at endpoint. ***Not an endpoint for this study but primary endpoint in the North American Study. ‡ Not significant. ‡‡ P values for Secondary Measures and Other Secondary Measures are nominal P values without any adjustment for multiplicity. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measure from Home Diary (from an 18-hour Diary Day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 9.2 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 9.3 | +1.5 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Duration of “On” time after first AM dose (hrs) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 2.2 | 0.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 2.1 | +0.2 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures from Home Diary (from an 18-hour Diary Day) ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 5.3 | 0.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 5.5 | - 1.3 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Proportion of Awake Time “On”***(%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 63.8 | +0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 62.7 | +9.3 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 705 | +14 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 701 | -87 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intakes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.1 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.2 | -0.4 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Other Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Investigator’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 28 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 56 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Patient’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 22 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 39 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 37.4 | -1.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 38.5 | -4.8 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 24.6 | -0.7 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 25.5 | -3.3 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 11.0 | -0.4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 11.2 | -1.8 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| *Mean; the month 6 values represent the average of weeks 8, 16, and 24, by protocol-defined outcome measure, except for Investigator’s and Patient’s Global Improvement.**At least one category change at endpoint. ***Score change at endpoint similarly to the Nordic Study. ‡ Not significant. ‡‡ P values for Secondary Measures and Other Secondary Measures are nominal P values without any adjustment for multiplicity. Effects on “On” time did not differ by age, sex, weight, disease severity at baseline, levodopa dose and concurrent treatment with dopamine agonists or selegiline | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measure from Home Diary (for a 24-hour Diary Day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Percent of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 60.8 | +2.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 60.0 | +6.7 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures from Home Diary (from an 24-hour Diary Day) ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.6 | -0.3 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.8 | -1.2 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 10.3 | +0.4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 10.2 | +1.0 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 758 | +19 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 804 | -93 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intakes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.0 | +0.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.2 | 0.0 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Other Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Investigator’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 21 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 34 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Patient’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 20 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 31 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 35.6 | +2.8 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 35.1 | -0.6 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 22.6 | +1.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 22.0 | -0.9 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 11.7 | +1.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 11.9 | 0.0 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Withdrawal of entacapone
In the third placebo-controlled study, a total of 301 patients were randomized in 32 centers in Germany and Austria. In this study, as in the other two studies, entacapone 200 mg was administered with each dose of levodopa and dopa decarboxylase inhibitor (up to 10 times daily) and UPDRS Parts II and III and total daily “On” time were the primary measures of effectiveness. The following results were observed for the primary measures, as well as for some secondary measures:
| * Total population; score change at endpoint. ** Fluctuating population, with 5 doses to 10 doses; score change at endpoint. *** Total population; at least one category change at endpoint. ‡ Not significant. ‡‡ P values for Secondary Measures are nominal P values without any adjustment for multiplicity. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6 | p-value vs. placebo (LOCF) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 12.0 | +0.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 12.4 | -0.4 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 24.1 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 24.9 | -2.5 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 10.1 | +0.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 10.2 | +1.1 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6 | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 37.7 | +0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 39.0 | -3.4 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Percent of Awake Time “On” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 59.8 | +3.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 62.0 | +6.5 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.8 | -0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.3 | -1.2 | 0.07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg)* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 572 | +4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 566 | -35 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intake* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 5.6 | +0.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 5.4 | 0.0 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Global (overall) % Improved*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 34 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 38 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Entacapone tablet’s effectiveness has not been systematically evaluated in patients with Parkinson’s disease who do not experience end-of-dose “wearing-off”.
The recommended dose of entacapone tablets is one 200 mg tablet administered concomitantly with each levodopa and carbidopa dose to a maximum of 8 times daily (200 mg x 8 = 1,600 mg per day). Clinical experience with daily doses above 1,600 mg is limited.
Entacapone tablets should always be administered in association with levodopa and carbidopa. Entacapone has no antiparkinsonian effect of its own.
In clinical studies, the majority of patients required a decrease in daily levodopa dose if their daily dose of levodopa had been greater than or equal to 800 mg or if patients had moderate or severe dyskinesia before beginning treatment.
To optimize an individual patient’s response, reductions in daily levodopa dose or extending the interval between doses may be necessary. In clinical studies, the average reduction in daily levodopa dose was about 25% in those patients requiring a levodopa dose reduction. (More than 58% of patients with levodopa doses above 800 mg daily required such a reduction.)
Entacapone tablets can be combined with both the immediate and sustained-release formulations of levodopa and carbidopa.
Entacapone tablets may be taken with or without food (see
Entacapone is a selective and reversible inhibitor of COMT.
In mammals, COMT is distributed throughout various organs with the highest activities in the liver and kidney. COMT also occurs in the heart, lung, smooth and skeletal muscles, intestinal tract, reproductive organs, various glands, adipose tissue, skin, blood cells, and neuronal tissues, especially in glial cells. COMT catalyzes the transfer of the methyl group of S-adenosyl-L-methionine to the phenolic group of substrates that contain a catechol structure. Physiological substrates of COMT include dopa, catecholamines (dopamine, norepinephrine, and epinephrine) and their hydroxylated metabolites. The function of COMT is the elimination of biologically active catechols and some other hydroxylated metabolites. In the presence of a decarboxylase inhibitor, COMT becomes the major metabolizing enzyme for levodopa, catalyzing the metabolism to 3-methoxy-4-hydroxy-L-phenylalanine (3-OMD) in the brain and periphery.
The mechanism of action of entacapone is believed to be through its ability to inhibit COMT and alter the plasma pharmacokinetics of levodopa. When entacapone is given in conjunction with levodopa and an aromatic amino acid decarboxylase inhibitor, such as carbidopa, plasma levels of levodopa are greater and more sustained than after administration of levodopa and an aromatic amino acid decarboxylase inhibitor alone. It is believed that at a given frequency of levodopa administration, these more sustained plasma levels of levodopa result in more constant dopaminergic stimulation in the brain, leading to greater effects on the signs and symptoms of Parkinson’s disease. The higher levodopa levels also lead to increased levodopa adverse effects, sometimes requiring a decrease in the dose of levodopa.
In animals, while entacapone enters the central nervous system (CNS) to a minimal extent, it has been shown to inhibit central COMT activity. In humans, entacapone inhibits the COMT enzyme in peripheral tissues. The effects of entacapone on central COMT activity in humans have not been studied.
When 200 mg entacapone is administered together with levodopa and carbidopa, it increases the area under the curve (AUC) of levodopa by approximately 35% and the elimination half-life of levodopa is prolonged from 1.3 hours to 2.4 hours. In general, the average peak levodopa plasma concentration and the time of its occurrence (Tmaxof 1 hour) are unaffected. The onset of effect occurs after the first administration and is maintained during long-term treatment. Studies in Parkinson’s disease patients suggest that the maximal effect occurs with 200 mg entacapone. Plasma levels of 3-OMD are markedly and dose-dependently decreased by entacapone when given with levodopa and carbidopa.
Entacapone pharmacokinetics are linear over the dose range of 5 mg to 800 mg, and are independent of levodopa and carbidopa coadministration. The elimination of entacapone is biphasic, with an elimination half-life of 0.4 hour to 0.7 hour based on the β-phase and 2.4 hours based on the γ-phase. The γ-phase accounts for approximately 10% of the total AUC. The total body clearance after intravenous administration is 850 mL per min. After a single 200 mg dose of entacapone tablets , the Cmaxis approximately 1.2 mcg per mL.
The effectiveness of entacapone tablets as an adjunct to levodopa in the treatment of Parkinson’s disease was established in three 24-week multicenter, randomized, double-blind, placebo-controlled studies in patients with Parkinson’s disease. In two of these studies, patients had motor “fluctuations”, characterized by documented periods of “On” (periods of relatively good functioning) and “Off” (periods of relatively poor functioning), despite optimum levodopa therapy. There was also a withdrawal period following 6 months of treatment. In the third study, patients were not required to have motor fluctuations. Prior to the controlled part of the studies, patients were stabilized on levodopa for 2 weeks to 4 weeks. Entacapone tablets have not been systematically evaluated in patients who have Parkinson’s disease without motor fluctuations.
In the first two studies to be described, patients were randomized to receive placebo or entacapone 200 mg administered concomitantly with each dose of levodopa and carbidopa (up to 10 times daily, but averaging 4 doses to 6 doses per day). The formal double-blind portion of both studies was 6 months long. Patients recorded the time spent in the “On” and “Off” states in home diaries periodically throughout the duration of the study. In one study, conducted in the Nordic countries, the primary outcome measure was the total mean time spent in the “On” state during an 18-hour diary recorded day (6 AM to midnight). In the other study, the primary outcome measure was the proportion of awake time spent over 24 hours in the “On” state.
In addition to the primary outcome measure: the amount of time spent in the “Off” state, subparts of the Unified Parkinson’s Disease Rating Scale (UPDRS) including mentation (Part I), activities of daily living (ADL) (Part II), motor function (Part III), complications of therapy (Part IV), and disease staging (Part V and VI) were assessed. Additional secondary endpoints included the investigator’s and patient’s global assessment of clinical condition, a 7-point subjective scale designed to assess global functioning in Parkinson’s disease; and the change in daily levodopa and carbidopa dose.
In one of the studies, 171 patients were randomized in 16 centers in Finland, Norway, Sweden, and Denmark (Nordic study), all of whom received concomitant levodopa plus dopa-decarboxylase inhibitor (either levodopa and carbidopa or levodopa and benserazide). In the second study, 205 patients were randomized in 17 centers in North America (US and Canada); all patients received concomitant levodopa and carbidopa.
The following tables display the results of these two studies:
| *Mean; the month 6 values represent the average of weeks 8, 16, and 24, by protocol-defined outcome measure, except for Investigator’s and Patient’s Global Improvement.**At least one category change at endpoint. ***Not an endpoint for this study but primary endpoint in the North American Study. ‡ Not significant. ‡‡ P values for Secondary Measures and Other Secondary Measures are nominal P values without any adjustment for multiplicity. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measure from Home Diary (from an 18-hour Diary Day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 9.2 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 9.3 | +1.5 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Duration of “On” time after first AM dose (hrs) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 2.2 | 0.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 2.1 | +0.2 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures from Home Diary (from an 18-hour Diary Day) ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 5.3 | 0.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 5.5 | - 1.3 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Proportion of Awake Time “On”***(%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 63.8 | +0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 62.7 | +9.3 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 705 | +14 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 701 | -87 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intakes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.1 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.2 | -0.4 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Other Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Investigator’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 28 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 56 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Patient’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 22 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 39 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 37.4 | -1.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 38.5 | -4.8 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 24.6 | -0.7 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 25.5 | -3.3 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 11.0 | -0.4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 11.2 | -1.8 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| *Mean; the month 6 values represent the average of weeks 8, 16, and 24, by protocol-defined outcome measure, except for Investigator’s and Patient’s Global Improvement.**At least one category change at endpoint. ***Score change at endpoint similarly to the Nordic Study. ‡ Not significant. ‡‡ P values for Secondary Measures and Other Secondary Measures are nominal P values without any adjustment for multiplicity. Effects on “On” time did not differ by age, sex, weight, disease severity at baseline, levodopa dose and concurrent treatment with dopamine agonists or selegiline | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measure from Home Diary (for a 24-hour Diary Day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Percent of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 60.8 | +2.0 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 60.0 | +6.7 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures from Home Diary (from an 24-hour Diary Day) ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.6 | -0.3 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.8 | -1.2 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 10.3 | +0.4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 10.2 | +1.0 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 758 | +19 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 804 | -93 | less than 0.001 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intakes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.0 | +0.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.2 | 0.0 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Other Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6* | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Investigator’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 21 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 34 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Patient’s Global (overall) % Improved** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 20 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 31 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 35.6 | +2.8 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 35.1 | -0.6 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 22.6 | +1.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 22.0 | -0.9 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 11.7 | +1.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 11.9 | 0.0 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Withdrawal of entacapone
In the third placebo-controlled study, a total of 301 patients were randomized in 32 centers in Germany and Austria. In this study, as in the other two studies, entacapone 200 mg was administered with each dose of levodopa and dopa decarboxylase inhibitor (up to 10 times daily) and UPDRS Parts II and III and total daily “On” time were the primary measures of effectiveness. The following results were observed for the primary measures, as well as for some secondary measures:
| * Total population; score change at endpoint. ** Fluctuating population, with 5 doses to 10 doses; score change at endpoint. *** Total population; at least one category change at endpoint. ‡ Not significant. ‡‡ P values for Secondary Measures are nominal P values without any adjustment for multiplicity. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primary Measures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6 | p-value vs. placebo (LOCF) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS ADL* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 12.0 | +0.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 12.4 | -0.4 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Motor* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 24.1 | +0.1 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 24.9 | -2.5 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “On” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 10.1 | +0.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 10.2 | +1.1 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Secondary Measures ‡‡ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Baseline | Change from Baseline at Month 6 | p-value vs. placebo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
UPDRS Total* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 37.7 | +0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 39.0 | -3.4 | less than 0.05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Percent of Awake Time “On” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 59.8 | +3.5 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 62.0 | +6.5 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hours of Awake Time “Off” (Home diary)** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 6.8 | -0.6 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 6.3 | -1.2 | 0.07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Levodopa Total Daily Dose (mg)* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 572 | +4 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 566 | -35 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frequency of Levodopa Daily Intake* | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | 5.6 | +0.2 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | 5.4 | 0.0 | less than 0.01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Global (overall) % Improved*** | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Placebo | - | 34 | - | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entacapone tablets | - | 38 | N.S.‡ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Entacapone tablets are contraindicated in patients who have demonstrated hypersensitivity to the drug or its ingredients.
Because clinical studies are conducted under widely varying conditions, the incidence of adverse reactions (number of unique patients experiencing an adverse reaction associated with treatment per total number of patients treated) observed in the clinical studies of a drug cannot be directly compared to the incidence of adverse reactions in the clinical studies of another drug and may not reflect the incidence of adverse reactions observed in practice.
A total of 1,450 patients with Parkinson’s disease were treated with entacapone tablets in premarketing clinical studies. Included were patients with fluctuating symptoms, as well as those with stable responses to levodopa therapy. All patients received concomitant treatment with levodopa preparations, however, and were similar in other clinical aspects.
The most commonly observed adverse reactions (incidence at least 3% greater than placebo) in double-blind, placebo-controlled studies (N=1,003) associated with the use of entacapone tablets were: dyskinesia, urine discoloration, diarrhea, nausea, hyperkinesia, abdominal pain, vomiting, and dry mouth. Approximately 14% of the 603 patients given entacapone in the double-blind, placebo-controlled studies discontinued treatment due to adverse reactions, compared to 9% of the 400 patients who received placebo. The most frequent causes of discontinuation in decreasing order were: psychiatric disorders (2% vs. 1%), diarrhea (2% vs. 0%), dyskinesia and hyperkinesia (2% vs. 1%), nausea (2% vs. 1%), and abdominal pain (1% vs. 0%).
Entacapone is available as tablets containing 200 mg entacapone.
Entacapone is an inhibitor of catechol-
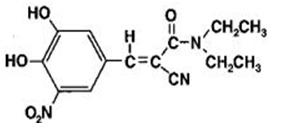
The inactive ingredients of the entacapone tablet are microcrystalline cellulose, sodium starch glycolate, hypromelloses, polyoxyl 40 hydrogenated castor oil, purified water, magnesium stearate, polyethylene glycols, ferric oxide red, ferric oxide yellow, titanium dioxide, polyvinyl alcohol and talc.
Entacapone is a selective and reversible inhibitor of COMT.
In mammals, COMT is distributed throughout various organs with the highest activities in the liver and kidney. COMT also occurs in the heart, lung, smooth and skeletal muscles, intestinal tract, reproductive organs, various glands, adipose tissue, skin, blood cells, and neuronal tissues, especially in glial cells. COMT catalyzes the transfer of the methyl group of S-adenosyl-L-methionine to the phenolic group of substrates that contain a catechol structure. Physiological substrates of COMT include dopa, catecholamines (dopamine, norepinephrine, and epinephrine) and their hydroxylated metabolites. The function of COMT is the elimination of biologically active catechols and some other hydroxylated metabolites. In the presence of a decarboxylase inhibitor, COMT becomes the major metabolizing enzyme for levodopa, catalyzing the metabolism to 3-methoxy-4-hydroxy-L-phenylalanine (3-OMD) in the brain and periphery.
The mechanism of action of entacapone is believed to be through its ability to inhibit COMT and alter the plasma pharmacokinetics of levodopa. When entacapone is given in conjunction with levodopa and an aromatic amino acid decarboxylase inhibitor, such as carbidopa, plasma levels of levodopa are greater and more sustained than after administration of levodopa and an aromatic amino acid decarboxylase inhibitor alone. It is believed that at a given frequency of levodopa administration, these more sustained plasma levels of levodopa result in more constant dopaminergic stimulation in the brain, leading to greater effects on the signs and symptoms of Parkinson’s disease. The higher levodopa levels also lead to increased levodopa adverse effects, sometimes requiring a decrease in the dose of levodopa.
In animals, while entacapone enters the central nervous system (CNS) to a minimal extent, it has been shown to inhibit central COMT activity. In humans, entacapone inhibits the COMT enzyme in peripheral tissues. The effects of entacapone on central COMT activity in humans have not been studied.